Blind Dating in der Bakterien-Evolution
Forschung an uralten Proteinen zeigt, dass sich die Fähigkeit zur Wechselwirkung rein zufällig entwickeln kann
Ein Forscherteam des Max-Planck-Instituts für terrestrische Mikrobiologie in Marburg und der Technischen Universität Berlin rekonstruierte längst ausgestorbene Proteine eines UV-Schutzsystems von Cyanobakterien. Das überraschende Ergebnis: die Proteine passten bereits perfekt zueinander, als sie aufeinandertrafen. Diese Entdeckung erweitert die bisherige Kenntnisse zu den Spielregeln der Evolution.
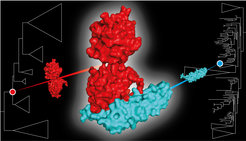
Proteine sind die Schlüsselakteure bei nahezu allen molekularen Vorgängen in der Zelle. Um ihre unterschiedlichen Funktionen zu erfüllen, müssen sie mit anderen Proteinen interagieren. Solche Wechselwirkungen werden durch äußerst komplementäre Schnittstellen vermittelt. Hier sind in der Regel viele Aminosäuren ganz genau positioniert, um eine enge, spezifische Passung zwischen den Proteinen herzustellen.
Die klassische Evolutionstheorie geht davon aus, dass sich jedes neue biologische Merkmal, das viele Komponenten umfasst (wie die Aminosäuren, die eine Interaktion zwischen Proteinen ermöglichen), stufenweise entwickelt. Nach diesem Konzept wird jede noch so kleine funktionelle Verbesserung durch die Kraft der natürlichen Auslese vorangetrieben, weil mit dem neuen Merkmal ein gewisser Nutzen verbunden ist. Ob jedoch auch Protein-Protein-Wechselwirkungen stets diesem Prozess folgen, war nicht hinreichend geklärt.
Ein internationales Team unter Leitung von Dr. Georg Hochberg vom Max-Planck-Institut für terrestrische Mikrobiologie ist dieser Frage nun in einem hoch interdisziplinären Ansatz auf den Grund gegangen. Ihre Studie, die kürzlich in der Zeitschrift Nature Ecology and Evolution veröffentlicht wurde, liefert den eindeutigen Beweis, dass sich hochgradig komplementäre und biologisch relevante Protein-Protein-Interaktionen rein zufällig entwickeln können.
Zusammenarbeit im Lichtschutzsystem
Das Forscherteam machte die Entdeckung in einem biochemischen System, das Mikroben zur Anpassung an widrige Lichtverhältnisse verwenden. Cyanobakterien nutzen Sonnenlicht, um mittels Photosynthese ihre eigene Nahrung zu produzieren. Da zu viel Licht die Zelle schädigt, haben Cyanobakterien einen Mechanismus entwickelt, der als Photoprotektion bekannt ist: Wenn die Lichtintensität gefährlich hoch wird, ändert ein Lichtintensitäts-Sensor namens Orange Carotenoid Protein (OCP) seine Form. In dieser aktivierten Form schützt OCP die Zelle, indem es die überschüssige Lichtenergie in harmlose Wärme umwandelt. Um wieder in den Ausgangszustand zurückkehren zu können, sind einige OCPs auf ein zweites Protein angewiesen: Das Fluorescence Recovery Protein (FRP) bindet an aktiviertes OCP1 und beschleunigt immens dessen Wiederherstellung.
"Wir fragten uns: Ist es möglich, dass die Strukturen, die es diesen beiden Proteinen ermöglichen, einen Komplex zu bilden, rein zufällig und nicht durch direkte natürliche Selektion entstanden sind?", sagt Georg Hochberg. "Die Schwierigkeit besteht darin, dass das Ergebnis beider Prozesse gleich aussieht. Wir können normalerweise nicht sagen, weshalb sich gerade die für eine bestimmte Interaktion erforderlichen Aminosäuren entwickelt haben, ob durch natürliche Selektion oder durch Zufall. Dazu bräuchten wir eine Zeitmaschine, mit der wir den genauen Zeitpunkt des Auftretens dieser Mutationen beobachten können", erklärt Georg Hochberg.
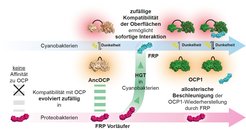
Glücklicherweise geben die jüngsten Fortschritte in der Molekularbiologie und der computergestützten Biologie Georg Hochberg und seinem Team eine Art Zeitmaschine für das Labor an die Hand: die Ahnen-Rekonstruktion von Protein-Sequenzen. Zudem ist das Lichtschutz-System der Cyanobakterien, mit dem sich die Gruppe von Prof. Thomas Friedrich an der Technischen Universität Berlin seit mehreren Jahren beschäftigt, ideal dafür geeignet, um das evolutionäre Zusammentreffen zweiter Proteinkomponenten zu erforschen. Frühe Cyanobakterien erhielten die FRP-Proteine eines Proteobakteriums durch horizontalen Gentransfer. Dieses hatte selbst keine Fähigkeit zur Photosynthese und damit auch keine Verwendung für diese spezielle Wechselwirkung.
Um herauszufinden, wie sich die Interaktion zwischen OCP1 und FRP entwickelt hat, rekonstruierte Niklas Steube, Erstautor der Studie und Doktorand am Marburger Max-Planck-Institut, die Sequenzen der OCP- und FRP-Proteine, die vor Milliarden von Jahren existierten. Anschließend übersetzte er die Aminosäure-Sequenzen in DNA und ließ sie in E.coli-Bakterienzellen erzeugen, um ihre molekularen Eigenschaften untersuchen zu können.
Ein glücklicher Zufall
Das Berliner Team um Prof. Thomas Friedrich und den Doktoranden Marcus Moldenhauer prüfte, ob die Moleküle miteinander interagieren. So konnte das Team zurückverfolgen, wann sich die beiden Proteinpartner kennengelernt haben. „Überraschenderweise passte das FRP aus den Proteobakterien bereits zum dem Ur-OCP der Cyanobakterien, noch bevor der Gentransfer stattgefunden hatte. Die gegenseitige Kompatibilität von FRP und OCP hat sich also völlig unabhängig voneinander in unterschiedlichen Arten entwickelt", sagt Thomas Friedrich.
Damit konnte das Team nachweisen, dass die Fähigkeit der Proteine zur Wechselwirkung ein glücklicher Zufall gewesen sein muss: Da sich die beiden Proteine zuvor nie begegnet sind, kann es nicht Selektion gewesen sein, die ihre Oberflächen so gestaltete, dass eine Wechselwirkung möglich war. Damit wurde nun erstmals bewiesen, dass sich Wechselwirkungen dieser Art auch ohne direkten Selektionsdruck entwickeln können.
„Das mag wie ein außergewöhnlicher Zufall erscheinen", sagt Niklas Steube. „Ungefähr so, als landete ein außerirdisches Raumschiff auf der Erde und wir stellen fest, dass es steckerförmige Objekte enthält, die perfekt in die vom Menschen geschaffenen Steckdosen passen. Aber tatsächlich treffen Proteine häufig auf eine große Anzahl neuer potenzieller Interaktionspartner, wenn sich Lokalisierungs- oder Expressionsmuster innerhalb der Zelle ändern, oder wenn durch horizontale Gentransfers neue Proteine in die Zelle gelangen.“
Georg Hochberg fügt hinzu: "Selbst wenn nur ein kleiner Teil solcher Begegnungen produktiv ist, könnte die zufällige Kompatibilität als Grundlage für einen bedeutenden Teil der Interaktionen dienen, die wir heute in Zellen vorfinden. Wie in menschlichen Partnerschaften könnte demnach auch in der Evolution eine gute Verbindung die Folge eines zufälligen Zusammentreffens zweier kompatibler Partner sein.“
FRP nutzt heute eine hoch konservierte Dimerisierungsschnittstelle von OCP, um OCP1-Paraloge stark allosterisch zu kontrollieren. Die hier nur zur Veranschaulichung verwendete OCP-Struktur ist 3MG1 (PDB ID).













