Regulation der mitochondrialen Morphologie während der sexuellen Entwicklung von Ustilago maydis
Forschungsbericht (importiert) 2006 - Max-Planck-Institut für terrestrische Mikrobiologie
Einleitung
Der Basidiomycet Ustilago maydis ist ein Vertreter der Brandpilze (Ustilaginales), die weltweit verbreitet sind und mit etwa 1200 Vertretern mehr als 75 Familien der Bedecktsamer befallen. U. maydis befällt Mais (Zea mays) und seine Urform Teosinte (Zea mays ssp. parviglumis) und verursacht als besonderes Merkmal die Bildung von Tumoren, in denen die massive Vermehrung und Reifung pilzlicher Teliosporen stattfindet.
U. maydis kann in seiner hefeartigen Wachstumsform im Labor kultiviert werden. Der Übergang zur pathogenen Form ist mit einem Dimorphismus verbunden, der nach Erkennung und Fusion zweier kompatibler Kreuzungspartner eingeleitet wird. Die entstehende dikaryotische Zelle ist für eine Proliferation auf die Pflanze angewiesen. Sie wächst als filamentöse Hyphe und dringt in die Pflanze ein, wo der sexuelle Lebenszyklus mit der Bildung der diploiden Teliosporen abgeschlossen wird [1, 2].
Die Kontrolle des sexuellen Lebenszyklus von U. maydis erfolgt über ein tetrapolares Paarungssystem, das durch die beiden Paarungstyp-Loci a und b bestimmt wird. Der biallelische a-Locus (a1 und a2) ermöglicht die Zellerkennung und die sich anschließende Zellfusion. Die in den a-Loci enthaltenen Gene kodieren jeweils eine Pheromonvorstufe und einen Rezeptor, der das Pheromon des entgegengesetzten Paarungstyps erkennt. Der multiallelische b-Locus enthält die Gene bE und bW, die Homeodomänen-Proteine kodieren. Nach erfolgter Zellfusion entsteht aus nicht-allelischen Kombinationen von bE und bW der zentrale Regulator für die pathogene Entwicklung [2].
U. maydis stellt neben den human- bzw. phytopathogenen Pilzen Cryptococcus neoformans und Magnaporthe grisea das am intensivsten untersuchte pilzliche Pathogensystem dar und bietet ein breites Spektrum molekularbiologischer Anwendungen, das durch die kürzlich publizierte Genomsequenz erweitert wird [2, 3].
Die a2-Locus-Gene lga2 und rga2 interferieren mit der pathogenen Entwicklung von U. maydis
Der a2-Locus enthält zusätzlich zu dem Pheromon- und Rezeptorgen die beiden Gene lga2 und rga2, die kleine mitochondriale Proteine unbekannter Funktion kodieren und für die Pathogenese entbehrlich sind. Zur Beantwortung der Frage, welche Rolle die Lga2- und Rga2-Proteine in U. maydis spielen, hat sich die Untersuchung des U. maydis mrb1-Gens, das ein mitochondriales Protein der p32-Familie kodiert, als sehr hilfreich herausgestellt. p32-Proteine sind aus vielen eukaryotischen Organismen bekannt und an regulatorischen Prozessen in und außerhalb der Mitochondrien beteiligt [4]. Dikaryotische Hyphen, die aus kompatiblen Stämmen hervorgingen, in denen mrb1 mittels homologer Rekombination deletiert worden war, waren kaum noch in der Lage, Pathogenitätssymptome in infizierten Pflanzen hervorzurufen. Mikroskopische Untersuchungen ergaben, dass die Abwesenheit des mrb1- Gens zu einem Wachstumsdefekt dikaryotischer Hyphen in infiziertem Pflanzengewebe führte, während das Wachstum haploider Zellen in Kultur oder die Ausbildung von Infektionsstrukturen auf der Pflanzenoberfläche nicht beeinflusst waren.
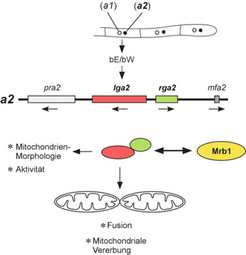
Erstaunlicherweise waren kompatible mrb1-Mutanten, wenn lga2 und rga2 zusätzlich im a2- Kreuzungspartner deletiert wurden, in ihrer pathogenen Entwicklung nicht mehr eingeschränkt. Offenbar interferierten die Produkte dieser Gene mit der pathogenen Entwicklung von mrb1-Mutanten (Abb. 1). Hierbei übernahm lga2 die Hauptfunktion, da eine entsprechende Deletion ausreichend war, um die pathogene Entwicklung in mrb1-Mutanten wieder vollständig herzustellen, während die Abwesenheit von rga2 nur eingeschränkte Pathogenität in mrb1-Mutanten ermöglichte [5]. Da die mitochondriale Lokalisierung von Mrb1 notwendig ist, um der Aktivität von Lga2 und Rga2 entgegenzuwirken, wird von einem Zusammenspiel dieser Proteine innerhalb der Mitochondrien ausgegangen.

Lga2 beeinflusst die zelluläre Fitness und die mitochondriale Integrität
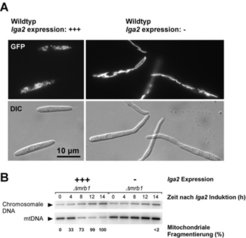
Die Expression der lga2- und rga2- Gene ist eng mit der sexuellen Entwicklung verbunden und wird über die Paarungstyp-Loci reguliert. Während der Pheromonstimulation kommt es zur Induktion beider Gene, und nach Zellfusion wird die lga2-Expression zusätzlich über den bE/bW-Komplex stimuliert [2, 6]. Dies erklärt, weshalb sich die mrb1-Mutation erst nach der Zellfusion auswirkt und somit selektiv das pathogene Stadium betrifft. Um Hinweise auf die Wirkungsweise von Lga2 zu erhalten, wurde lga2 unter einem induzierbaren Promotor in Wildtyp-Stämmen sowie in mrb1- Mutanten exprimiert. Dabei zeigte sich, dass die Anwesenheit von Lga2 zu einer massiven Beeinträchtigung der Zellvermehrung unter Kulturbedingungen führte. Zur Untersuchung des Einflusses von Lga2 auf die mitochondriale Morphologie wurden die Mitochondrien mit dem grün fluoreszierenden Protein (GFP) markiert und mittels Fluoreszenzmikroskopie untersucht. Während die Mitochondrien in Abwesenheit von Lga2 fadenartige Netzwerkstrukturen aufwiesen, zeigten Zellen, in denen lga2 überexprimiert wurde, eine Akkumulation punktförmiger Mitochondrien (Abb. 2A). Dies ließ darauf schließen, dass Lga2 mit der mitochondrialen Morphologie interferiert und eine Fragmentierung tubulärer Strukturen bewirkt. Weitere Konsequenzen einer lga2- Überxpression waren eine deutliche Verminderung der respiratorischen Aktivität sowie der selektive Verlust mitochondrialer DNA (mtDNA; Abb. 2B). Darüber hinaus wurden in mrb1-Mutanten diese Effekte bereits bei einem wesentlich geringeren lga2- Expressionslevel bewirkt, was das Zusammenspiel zwischen Lga2 und Mrb1 verdeutlicht [5]. Es erscheint daher wahrscheinlich, dass sich dikaryotische Hyphen bei Abwesenheit von mrb1 aufgrund eingeschränkter mitochondrialer Aktivität nicht mehr vermehren können.
Mögliche Funktionen der Lga2- und Rga2- Proteine während der sexuellen Entwicklung
Die Morphologie von Mitochondrien ist hochdynamisch und man weiß aus Untersuchungen in Saccharomyces cerevisiae, dass die Morphologie über entgegenwirkende Fusions- und Spaltungsereignisse aufrecht erhalten wird. Hierbei spielen Dynamin-ähnliche GTPase-Proteine eine Rolle, die mit der äußeren beziehungsweise inneren mitochondrialen Membran verbunden sind [7, 8, 9]. Die Fzo1- und Mgm1-Proteine sind konservierte mitochondriale Fusionsdeterminanten. Entsprechende Hefemutanten haben einen mitochondrialen Fusionsdefekt, weisen fragmentierte Mitochondrien auf und verlieren mtDNA. Diese Effekte erinnern an den Phänotyp, der infolge einer starken lga2-Expression in U. maydis-Zellen auftritt. Es ist daher vorstellbar, dass Lga2 mit der mitochondrialen Fusion interferiert und somit das Gleichgewicht zu Gunsten mitochondrialer Spaltung verschiebt. Derzeitige Untersuchungen deuten darauf hin, dass Lga2 entweder mitochondriale Fusion verhindert oder aber mitochondriale Spaltung aktiviert.
Aufgrund der Eigenschaften von Lga2, den selektiven Abbau mtDNA zu bewirken und mit der Fusion von Mitochondrien zu interferieren, stellte sich die Frage nach einer Rolle in der mitochondrialen Vererbung nach Zellfusion. Mittels Identifizierung von Markern zur Unterscheidung mitochondrialer Genome konnte uniparentale mitochondriale Vererbung in U. maydis nachgewiesen werden [5]. Aktuelle Untersuchungen deuten auf einen Einfluss der lga2- und rga2-Gene in der uniparentalen mitochondrialen Vererbung hin. U. maydis könnte dieses System vielleicht entwickelt haben, um mitochondriale Fusion und dadurch Rekombination unterschiedlicher mtDNA-Moleküle während der Paarung zu unterdrücken (Abb. 3). Obwohl in C. neoformans oder dem Schleimpilz Physarum polycephalum ein Einfluss des Paarungstyp-Locus auf die mitochondriale Vererbung dokumentiert wurde, sind die verantwortlichen molekularen Mechanismen derzeit allerdings unbekannt [10].
In weitergehenden Untersuchungen soll der Mechanismus aufgeklärt werden, der zum selektiven Abbau einer mtDNA-Population während der sexuellen Entwicklung führt. Darüber hinaus stellt sich die spannende Frage, ob lga2 auch während des Wachstums in der Wirtspflanze die mitochondriale Morphologie beziehungsweise Aktivität beeinflusst (Abb. 3). Aufgrund von Beobachtungen, dass sich die Mitochondrien-Morphologie während energetischer Herausforderungen und entwicklungsabhängiger Prozesse verändert [9], ist es vorstellbar, dass solche Prozesse auch bei der Anpassung an spezielle Bedingungen in der Wirtspflanze von Bedeutung sind.
Bislang sind nur wenige Beispiele mitochondrialer Funktionen bekannt, die für die Pathogenese von Pilzen von Bedeutung sind. Für das weitere Verständnis der Wirkungsweise von Lga2 wird es wesentlich sein, diejenigen Prozesse während der pilzlichen Entwicklung in der Pflanze zu identifizieren, die in direkter Konsequenz durch lga2-Expression beeinflusst werden.

![Einfluss der lga2-Expression auf die mitochondriale Morphologie und Stabilität der mtDNA. A lga2 wurde unter einem induzierbaren Promotor in einem Wildtyp-Stamm überexprimiert (linkes Bild). Ein entsprechender Wildtyp-Stamm, der lga2 nicht exprimiert, diente als Kontrolle (rechtes Bild). Zum Nachweis mitochondrialer Strukturen wurde mitochondrial-lokalisiertes GFP exprimiert. Die Zellen wurden entweder mittels Fluoreszenz- (GFP) oder DIC (differential interference contrast)-Mikroskopie beobachtet. Die lga2-Überexpression bewirkte Fragmentierung tubulärer mitochondrialer Strukturen. B Bereits wenige Stunden nach Induktion der lga2-Expression (+++) findet, einhergehend mit mitochondrialer Fragmentierung, eine deutliche Abnahme der Menge an mtDNA statt. Abbildung modifiziert nach [5]. Einfluss der lga2-Expression auf die mitochondriale Morphologie und Stabilität der mtDNA. A lga2 wurde unter einem induzierbaren Promotor in einem Wil](https://www.mpg.de/417043/zoom-1293750156.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6NDE3MDQzfQ%3D%3D--313bdcdae96e8484ed08db0aa90aa3139e02e174)
