Regulation von Sessilität und Motilität bei Shewanella
Forschungsbericht (importiert) 2011 - Max-Planck-Institut für terrestrische Mikrobiologie
Bakterielle Biofilme
Bakterien haben erfolgreich alle ökologischen Nischen unseres Planeten besiedelt. An ihren jeweiligen Standorten sind sie sich schnell ändernden Bedingungen ausgesetzt: Temperaturschwankungen, Strahlung, schwankende Salz- und Nährstoffgehalte sowie Fressfeinde, Artgenossen oder Protozoen oder auch die Immunsysteme von befallenen Wirtsorganismen können ihr Leben maßgeblich beeinträchtigen. Eine Form der erfolgreichen Adaptation von Bakterien an umweltinduzierte Stressbedingungen ist die Bildung von Zellaggregaten einer einzelnen oder - in den weitaus meistens Fällen - gemischten Spezies. Diese so genannten Biofilme bilden sich bevorzugt an Grenzflächen, zum Beispiel fest/flüssig oder flüssig/gasförmig, oder die Zellen aggregieren in flüssiger Umgebung. Rund 80 % aller Bakterien dieser Erde befinden sich in solchen Gemeinschaften. Die Zellen sind dabei in einer selbstproduzierten extrazellulären Matrix immobilisiert, die ihrerseits wiederum bis zu 80 % der Biomasse des Biofilms ausmachen kann. Die Bildung der assoziierten Gemeinschaften bietet den Zellen eine Reihe von Vorteilen: Die Matrix schützt die Zellen vor äußeren Einflüssen und bildet ein Nahrungsreservoir sowie ein Gerüst zur Immobilisierung extrazellulärer Proteine. Dazu ermöglicht die enge Assoziation mit einem Substrat direkte metabolische Interaktion mit der Oberfläche. Die räumliche Nähe der Zellen untereinander erleichtert den aktiven Austausch von Metaboliten und erlaubt, dass verschiedene Subpopulationen unterschiedliche Aufgaben wie die Bildung von Stoffwechselprodukten, den Aufbau der Matrix oder die Degradation bestimmter Moleküle übernehmen, wovon die Gesamtpopulation profitiert. Diese Gemeinschaften beinhalten häufig auch metabolisch inaktive Zellen. Als Gesamtheit zeigt ein Biofilm eine drastisch erhöhte Resistenz gegenüber allen Arten von Umwelteinflüssen - einschließlich Antibiotika, denn Bakterien in Biofilmen zeigen gegenüber vielen Antibiotika derart erhöhte Resistenzen, dass sie bei Patienten nicht mehr mit garantierter Wirkung angewendet werden können.
Damit hat sich das Bild von Bakterien als ausschließlich einzelliger Organismus grundlegend gewandelt. Eine Charakterisierung der bakteriellen Biofilmbildung ist somit essenziell, um die Eigenschaften der großen Mehrheit bakterieller Zellen in der Natur besser zu verstehen und um Biofilmbildung kontrollieren zu können, insbesondere in medizinischer oder industrieller Hinsicht.
Eine wichtige Rolle von DNA in der Biofilmbildung
Spezies des Genus Shewanella zeichnen sich durch ihre Fähigkeit aus, eine Reihe anorganischer Verbindungen zur anaeroben Atmung zu nutzen. Damit sind sie in der Lage, mit redoxaktiven Oberflächen zu interagieren. Die bakterielle Biofilmbildung, und damit auch die von Shewanella, beginnt mit Einzelzellen, die an eine Oberfläche binden. Diese Zellen beginnen mit der Bildung einer extrazellulären Matrix, die dann den Aufbau dreidimensionaler Strukturen erlaubt (Abb. 1).

Dabei handelt es sich zunächst um Mikrokolonien, und später, je nach den herrschenden Umgebungsbedingungen, um große pilzförmige oder auch netzwerkartige Strukturen. Eine Reihe daran beteiligter Faktoren, wie Beweglichkeit, Zellanhänge oder Matrixkomponenten, wurden bereits charakterisiert [1, 2]. Als sehr wichtige Matrixkomponente für alle Phasen der Biofilmbildung von Shewanella oneidensis MR-1 wurde extrazelluläre DNA (eDNA) identifiziert [3]. Diese stellte sich in den letzten Jahren als ein sehr verbreiteter Faktor bei der Biofilmbildung heraus; viele bakterielle Aggregate lösen sich bei Abbau extrazellulärer DNA sehr schnell auf [4]. eDNA ist häufig das Produkt der Zelllyse einer Subpopulation von Zellen. Studien an S. oneidensis-Zellen zeigten, dass die Zelllyse in dieser Spezies in erster Linie durch in das Bakterienchromosom integrierte temperente Viren, so genannte Bakteriophagen, verursacht wird. Sofort nach der Bindung an eine Oberfläche werden zwei dieser Phagen aktiviert und lysieren eine Subpopulation der Zellen. Tatsächlich sind phagenfreie Mutanten in ihrer Fähigkeit zur Biofilmbildung sehr stark eingeschränkt [3]. Damit stellen Viren einen Faktor bei der mikrobiellen Biofilmbildung da, dessen Wichtigkeit bisher stark unterschätzt wurde.
Eine weitere interessante Eigenschaft vieler bakterieller Spezies, darunter Shewanella, ist es, Biofilme aktiv verlassen zu können, um neue Habitate zu erschließen [2, 5]. Das Ablösen einzelner Zellen vom Biofilm wird durch partielle Auflösung der Matrix ermöglicht. Im Hinblick auf die wichtige Rolle von eDNA als Matrixkomponente war es daher naheliegend, Proteine mit DNA-degradierenden Eigenschaften zu untersuchen. Tatsächlich stellte sich heraus, dass Shewanella mehrere dieser extrazellulären Nukleasen besitzt, die vermutlich unterschiedliche Aufgaben wahrnehmen. So ist eine dieser Nukleasen in erster Linie dafür verantwortlich, eDNA als Nährstoffquelle zu erschließen, während eine zweite in die Biofilmbildung involviert ist. Damit könnte der Abbau von eDNA durch Zugabe von Nukleasen oder die Stimulierung von Enzymen, die vergleichbare Aktivitäten aufweisen, ein mögliches Mittel darstellen, die Biofilmbildung bestimmter Bakterienspezies zu kontrollieren [6].
Adaptation der Flagellen
Eine Vielzahl bakterieller Spezies ist durch Flagellen, das sind lange rotierende helikale Proteinfilamente, beweglich. Sie ermöglichen im Zusammenspiel mit so genannten Chemotaxissystemen eine Bewegung in Richtung oder Gegenrichtung eines Signals. Bakterielle Flagellensysteme können, je nach Spezies, an verschiedenen Stellen des Zellkörpers und in unterschiedlicher Anzahl gebildet werden. Eine gerichtete Bewegung ist, genauso wie die Fähigkeit zur Biofilmbildung, ebenfalls ein wichtiger Überlebensfaktor. Zusätzlich können Flagellen wichtige Messinstrumente der Zellen darstellen, um zum Beispiel die Feuchtigkeit oder die Viskosität des umgebenden Mediums wahrzunehmen. Bakterielle Spezies bedienen sich deswegen mehrerer Methoden, um sicherzustellen, dass die Funktionalität ihres Flagellensystems sich ändernden Bedingungen angepasst werden kann.
Der Flagellenmotor: Ein dynamischer Komplex
Der bakterielle Flagellenmotor ist eine molekulare Nanomaschine [7], die im Lauf der Forschung zu einem Modell zur Assemblierung, Dynamik und Funktion bakterieller Multiproteinkomplexe geworden und deren Funktion noch immer nicht vollständig aufgeklärt ist. Der in die Zellmembran eingebettete Komplex nutzt transmembrane Ionengradienten, um die Rotation der Flagelle anzutreiben. Bisher geht man von zwei Motortypen aus: Protonen-abhängige, wie zum Beispiel dem des peritrichen Systems von Escherichia coli, sowie Natriumionen-abhängige, wie dem des polaren Flagellensystems der Vibrio-Spezies. Das Drehmoment wird zwischen den beiden Hauptbestandteilen des Motors erzeugt, dem Rotor und dem Stator (Abb. 2).
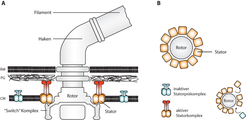
Die Analyse sequenzierter Bakteriengenome zeigte, dass eine Reihe bakterieller Spezies verschiedene Statorkomplexe besitzt, darunter S. oneidensis MR-1 [8]. Physiologische und fluoreszenzmikroskopische Analysen zeigten, dass die Zellen in Reaktion auf in der Umgebung sich ändernde Natriumionen-Konzentrationen den Flagellenmotor umbauen, indem sie die Statoren auswechseln. Dadurch wird die Energiequelle des Motors von Natriumionen vermutlich auf ein Gemisch aus Natriumionen und Protonen umgestellt, also sozusagen auf einen „bakteriellen Hybridmotor“, während die Flagelle rotiert. Wir vermuten, dass dieses „Motortuning“ eine weit verbreitete Methode zur Anpassung der bakteriellen Flagellenfunktion darstellt und außerdem zeigt, wie die Aktivität eines hoch entwickelten Multiproteinkomplexes durch Austausch von Komponenten moduliert werden kann [9]. Zukünftige Experimente werden zeigen, ob andere Bakterienspezies die Funktion des Flagellenmotors auf diese oder ähnliche Art modulieren.

