Synthetische Kohlenstoffdioxid-Fixierung
Forschungsbericht (importiert) 2016 - Max-Planck-Institut für terrestrische Mikrobiologie
Chemie und Biologie der Kohlenstoff-Fixierung
Die wichtigste Reaktion im globalen Kohlenstoffkreislauf ist die Umwandlung von atmosphärischem Kohlenstoffdioxid (CO2) in organische Materie. Dieser Prozess, der auch als Kohlenstoff-Fixierung bezeichnet wird, ernährt sprichwörtlich alles Leben auf der Erde: Die fotosynthetische Kohlenstoff-Fixierung von Pflanzen steht am Anfang unserer Nahrungskette. Darüber hinaus bildet fixierter Kohlenstoff in Form fossiler Rohstoffe die Grundlage unserer modernen Industrie- und Energieproduktion. Da aber fossile Rohstoffe endlich sind und die Konzentrationen des Treibhausgases CO2 stetig steigen, wird vermehrt nach neuen Möglichkeiten gesucht, eine nachhaltige Kohlenstoffökonomie der Zukunft zu verwirklichen.
Trotz intensiver Forschung gelang es der Chemie bisher nicht, Katalysatoren zu entwickeln, die es erlauben, im Großmaßstab atmosphärisches CO2 unter milden Prozessbedingungen in Mehrfachkohlenstoffverbindungen zu überführen. Im Gegensatz dazu bietet die Biologie mehrere Lösungen. Die bekannteste ist die bereits erwähnte fotosynthetische Kohlenstoff-Fixierung in Pflanzen, der Calvin-Zyklus, durch den netto fast 70 Gigatonnen Kohlenstoff pro Jahr fixiert werden. Neben Pflanzen nutzen auch Algen und viele Bakterien den Calvin-Zyklus. Insgesamt werden geschätzt rund 90 Prozent im globalen Kohlenstoffkreislauf über diesen Stoffwechselweg gebunden. In den letzten Jahren wurden fünf weitere, alternative Stoffwechselwege zur Kohlenstoff-Fixierung in Mikroorganismen entdeckt, die ebenfalls eine wichtige Rolle im globalen Kohlenstoffkreislauf spielen und Gegenstand aktueller Untersuchungen sind [1, 2].
Obwohl diese natürlich entstandenen Stoffwechselwege im Gigatonnen-Maßstab CO2 fixieren, sind sie in vielerlei Hinsicht nicht perfekt. Das Produkt biologischer Kohlenstoff-Fixierung ist Biomasse, ein komplexes Gemisch, das sich nicht als Rohstoff für die chemische Industrie eignet. Hinzu kommt, dass viele natürliche Stoffwechselwege in ihrer Kohlenstoff-Fixierung limitiert sind. Ein Beispiel ist der Calvin-Zyklus selbst mit seinem CO2-bindenden Enzym RubisCO. Die RubisCO setzt nur fünf bis zehn Moleküle CO2 pro Sekunde um. Gleichzeitig zeigt das Enzym eine unerwünschte Nebenreaktion mit Sauerstoff. Eine durchschnittliche RubisCO besitzt eine Fehlerrate von etwa 20 Prozent mit Sauerstoff, was die Effizienz der Fotosynthese stark einschränkt.
Neue CO2-bindende Enzyme eröffnen neue Möglichkeiten
Gibt es Alternativen zur RubisCO-abhängigen Kohlenstoff-Fixierung? Vor einiger Zeit wurde in Alphaproteobakterien eine neue Familie CO2-bindender Enzymen entdeckt, die reduktiven Enoyl-CoA Ester Carboxylasen (ECRs, Abb. 1). Diese Enzyme sind interessant, weil sie bis zu 120 CO2 Moleküle pro Sekunde umsetzen können und damit zwanzigmal schneller CO2 fixieren können als die RubisCO und weil sie keine Seitenreaktion mit Sauerstoff zeigen [3]. Um zu verstehen, was ECRs zu so effizienten CO2-bindenden Enzymen macht, wurde mithilfe speziell entwickelter spektroskopischer Methoden der Katalyse-Zyklus dieser Enzyme untersucht. Dadurch konnten einzelne chemische Vorgänge während der Katalyse zeitaufgelöst dargestellt werden, vergleichbar mit einer Art Enzym-Zeitlupe [4]. Diese detaillierten Einblicke in die Biochemie der ECRs legten die Grundlage, diese Enzyme gezielt zur CO2-Bindung zu modifizieren. Unter Zuhilfenahme von Enzym-Kristallstrukturen [5] wurde das Substratspektrum von ECRs durch Mutagenese des aktiven Zentrums erweitertet. Damit steht eine Vielzahl neuer, effizienten CO2-Bindungsreaktionen für die Biokatalyse zur Verfügung [6].
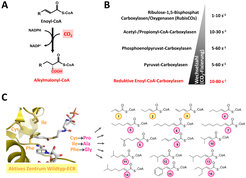
Die synthetische Biologie zeigt neue Wege zur CO2-Fixierung
Wie können diese neuen Reaktionen zur Kohlenstoff-Fixierung eingesetzt werden? Eine Idee ist, mithilfe synthetischer Biologie künstliche Kohlenstoff-Fixierungswege zu entwerfen, die natürlich entstandenen Stoffwechselwegen überlegen sind [7,8]. Mehrere Labore haben sich diesem Ziel verschrieben. Bisher allerdings konnte kein künstlicher Kohlenstoff-Fixierungsweg realisiert werden. Viele Ansätze scheiterten an dem Versuch, solche künstlichen Stoffwechselwege direkt in lebenden Organismen zusammenzusetzen. Es fehlt das grundlegende biologische Verständnis, wie sich die einzelnen Enzyme im Zusammenspiel verhalten und wie sich der jeweilige künstliche Stoffwechselweg in den komplexen Metabolismus des Wirtes einfügt.
Aus diesem Grund gewinnen in letzter Zeit bottom-up Ansätze an Popularität, die eine reduktionistische Strategie verfolgen [8, 9]. In diesen Ansätzen werden künstliche Stoffwechselwege von Grunde auf aus einzelnen Enzymen schrittweise – eben bottom up – zusammengesetzt (Abb. 2). Dazu werden in einer ersten, theoretischen Phase mit Hilfe metabolischer Retrosynthese plausible biochemische Reaktionen zu möglichen Stoffwechselwegen kombiniert. Danach werden das thermodynamische Profil und der voraussichtliche Energie-Verbrauch dieser theoretischen Stoffwechselwege abgeschätzt, um bewerten zu können, welcher der Designer-Wege sich zur experimentellen Umsetzung eignet. Anhand dieser Vorgehensweise wurden kürzlich verschiedene synthetische Kohlenstoff-Fixierungswege entworfen, die alle auf einer effizienten ECR-Reaktion basieren. Berechnungen zeigen, dass diese theoretischen Zyklen durchschnittlich 20 Prozent weniger Energie pro gebundenem CO2 benötigen als der auf RubisCO-basierte Calvin-Zyklus, was das grundsätzliche Potential synthetischer Kohlenstoff-Fixierung unterstreicht [8].
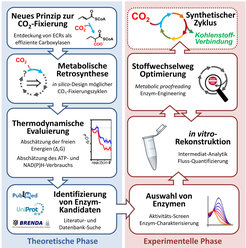
Vom Design zur Realisierung synthetischer CO2-Fixierung
Im Anschluss an die Design-Phase folgt die experimentelle Umsetzung der theoretischen Stoffwechselwege. Es gilt entsprechende Enzyme zu finden, die die einzelnen Reaktionen des jeweiligen Stoffwechselweges katalysieren. Eine wichtige Quelle zum Erfolg bilden Datenbanken, in denen bisher mehr als 40.000 verschiedene Enzymreaktionen abgelegt wurden. Dennoch kommt es vor, dass für einzelne Reaktionen bisher kein entsprechendes Enzym beschrieben wurde. Mittels Durchmustern von (meta-) genomischen Bibliotheken oder durch gezieltes Protein-Engineering können diese fehlenden Enzyme gefunden beziehungsweise maßgeschneidert werden.
Ein anderes Problem bei der Realisierung synthetischer Stoffwechselwege ist die Neukombination von Enzyme aus völlig unterschiedlichen Organismen in einen gemeinsamen Stoffwechselweg. Dadurch geraten viele Enzyme mit Stoffwechselprodukten in Berührung, denen sie im Laufe der Evolution nie ausgesetzt waren. Es zeigen sich oft unerwünschte Seitenreaktionen und Inhibitionen, die es zu verhindern gilt. Um solche Seitenreaktionen zu minimieren, können einzelne Enzyme wiederum auch maßgeschneidert werden. Eine Alternative dazu ist das metabolic proofreading, das Hinzufügen zusätzlicher, korrigierender Enzyme, die die unerwünschten Seitenprodukte entfernen und wiederverwerten. Obwohl das Prinzip des Korrekturlesens aus natürlichen Stoffwechselwegen bekannt ist [10], wurde es bisher nicht systematisch im metabolischem Engineering beziehungsweise der synthetischen Biologie eingesetzt. Erste Erfahrung im Umsetzen der synthetischen CO2-Fixierung zeigen jedoch, dass das metabolische Korrekturlesen die Effizienz von Designer-Stoffwechselwegen um bis zu einen Faktor zehn steigern kann [8].
Der CETCH-Zyklus: Vom Reagenzglas in lebende Organismen
Am Ende des Gesamtprozesses steht ein funktionsfähiger Stoffwechselweg in vitro, das heißt, im Reagenzglas. Für einen künstlichen Kohlenstoff-Fixierungsweg, den CETCH-Zyklus, konnte dieses Ziel kürzlich erreicht werden (Abb. 3A). Der CETCH-Zyklus setzt sich aus insgesamt siebzehn Enzymen zusammen, die aus neun verschiedenen Organismen stammen, darunter befinden sich auch drei maßgeschneiderte Enzyme. Im Reagenzglas fixiert der CETCH-Zyklus CO2 mit einer Rate von 5 nmol CO2 pro Minute und mg Protein [8]. Diese Raten im Reagenzglas sind in etwa vergleichbar mit Messungen des Calvin-Zyklus in Zellextrakten.
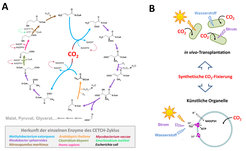
In vitro-Stoffwechselwege zur Kohlenstoff-Fixierung wie der CETCH-Zyklus bilden den Ausgangspunkt für weitere Untersuchungen (Abb. 3B). Zuallererst sind solche in vitro-Stoffwechselwege minimale Systeme, die es erlauben, die generelle Arbeitsweise, Plastizität und Robustheit komplexer metabolischer Netzwerke zu studieren. Zum anderen sind sie ein wichtiger Schritt in Richtung des großen Ziels synthetische CO2-Fixierung auch in vivo, das heißt im lebenden Organismus, zu erreichen. Durch Transplantation in geeignete Wirtsorganismen könnten sie eines Tages eventuell die fotosynthetische Effizienz erhöhen oder zur gezielten Produktion von chemischen Bausteinen aus refixiertem CO2 eingesetzt werden. Schließlich bieten synthetische Stoffwechselwege auch die Möglichkeit, neue Technologien an der Schnittstelle zwischen Nano- und Biotechnologie zu entwickeln, wie zum Beispiel biomimetische Organelle zur künstlichen Fotosynthese („künstliche Chloroplasten“).
Zusammenfassung
Die synthetische CO2-Fixierung ist ein Forschungsfeld an der Schnittstelle von Biologie und Chemie, das radikal neue Lösungen aufzeigen kann, die effizienter sein können als natürlich entstandene Stoffwechselwege. Die Konstruktion synthetischer Stoffwechselwege im bottom-up Ansatz ist eine Weiterentwicklung der Biologie von einer deskriptiv-analytischen zu einer synthetisch-konstruktiven Wissenschaft, die grundlegende Designprinzipien metabolischer Netzwerke offenlegt und neue (bio-) technologische Möglichkeiten eröffnen kann.
Danksagung
Die hier vorgestellten Arbeiten entstanden in Zusammenarbeit mit Marc-Olivier Ebert (ETH Zürich), Ivan Berg (Westfälische Wilhelms-Universität Münster) und Julia Vorholt (ETH Zürich). Dieser Bericht basiert in einigen Teilen auf einem Beitrag in BIOspektrum (DOI: 10.1007/s12268-016-0733-9), der mit Erlaubnis der Springer-Verlags GmbH (Heidelberg) verwendet wurde.


![Abb. 3: Der CETCH-Zyklus, ein synthetischer Stoffwechselweg zur kontinuierlichen Fixierung von CO2, der mit Hilfe der Strategie wie in in Abb. 2 dargestellt realisiert wurde [8]. (A) Topologie des CETCH-Zyklus. (B) Mögliche zukünftige Anwendungen des CETCH-Zyklus: Durch die Transplantation in verschiedene Organismen könnten künstliche CO2-Fixierungswege, wie der CETCH-Zyklus, effizienter als natürliche Stoffwechselwege CO2 in Biomasse oder gezielte Produkte umwandeln. Alternativ dazu könnten künstliche CO2-Fixierungswege die Basis für die Entwicklung artifizieller, biomimetischer Chloroplasten bilden, die von Strom, Wasserstoff oder Elektrizität angetrieben werden. Abb. 3: Der CETCH-Zyklus, ein synthetischer Stoffwechselweg zur kontinuierlichen Fixierung von CO2, der mit Hilfe der Strategie wie in in Abb. 2 darge](https://www.mpg.de/11634346/original-1508158452.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6MTE2MzQzNDZ9--3caa28b046ae84c8b205c5e1cafc8dee960b5110)